石灰新產業7|二氧化鈣的生產與新工藝應用
2024-07-29 08:55:34 來源:石灰窯生態圈
 石灰新產業7|二氧化鈣的生產與新工藝應用
一、過氧化鈣的傳統合成工藝
二氧化鈣即過氧化鈣,目前,傳統的過氧化鈣生產方法按所含鈣原料,可分為氫氧化鈣法、氧化鈣法和鈣鹽法(氯化鈣或碳酸鈣)等生產方法。
1.1、氫氧化鈣法
氫氧化鈣法有又可分為傳統法,空氣陰極法和噴霧干燥法。
1.1. 1 傳統法
傳統法主要是利用含鈣的化合物與過氧化物發生氧化還原反應來制備濕的過氧化鈣,然后再經過分離,脫水便可得過氧化鈣產品。
有關過氧化鈣的制備和放氧反應為:
Ca( OH ) 2 + H 2 O 2 → CaO 2 + 2H 2 O ( 1)
CaO 2 + H 2 O→ Ca( OH)2 + O 2 ( 2)
在這兩個反應中,其中反應(1)用于過氧化鈣的制備,反應(2)是過氧化鈣釋放活性氧的機理。
(1)、不用添加劑法
以氫氧化鈣和過氧化物來制備過氧化鈣:過氧化物通常是過氧化氫,Ca (OH) 2 造價較低,所以主要的原料成本來自過氧化氫,而過氧化氫在堿性條件下分解很快,為了降低其分解速度,減少成本,常采用濃的Ca( OH ) 2 懸浮液與H2O 2在常溫下反應制備過氧化鈣。
以氫氧化鈣和雙氧水為原料合成過氧化鈣:首先將反應混合物(漿料)冷卻。再加進氧化鈣去干燥此漿料,同時生成過氧化鈣產品,如需得無水過氧化鈣,則需進一步干燥。若用濃縮的氫氧化鈣水懸液,在冷卻和不斷攪拌下與濃縮的雙氧水反應,反應結束后所得混合物直接噴霧、干燥,不需分離、提純等過程,也可得到分散性好,粒度均勻的無水過氧化鈣產品。
(2)、用添加劑法
用氫氧化鈣制備過氧化鈣:通過加入新型穩定劑磷酸銨合成過氧化鈣,在用氫氧化鈣合成過氧化鈣時,以磷酸二氫鈉為穩定劑。該法不僅設備簡單、操作方便、與傳統的低溫合成法相比,在大大降低了能耗與成本的同時,也帶來了高品質的產品,而且無污染。穩定性好 。
用氫氧化鈣與過氧化氫反應制備過氧化鈣。不加穩定劑時,一般需要在0~5 ℃下進行反應;加入穩定劑后,反應可在室溫下進行。由于氫氧化鈣微溶于水,也有使其先在銨鹽溶液中溶解生成氨絡合物,然后利用絡合物解離出的Ca 2 +與H2O2反應,生成過氧化鈣的制備方法。
1.1. 2 空氣陰極法
空氣陰極法制備過氧化鈣的工藝,實質上是把過氧化鈣的合成與過氧化氫的生產結合起來,通過降低關鍵原料過氧化氫的成本,來降低*終產品過氧化鈣的生產成本。其基本原理是,在堿性條件下,空氣中的氧和水在特制的陰極上直接還原得過氧化氫,然后加入氫氧化鈣進行反應制得產品過氧化鈣
陰極:O 2 + H 2 O + 2e - → HO - 2 +OH -
陽極: 2OH - → 2e - +H 2 O + 1 /2O 2
此法生產能力比較小,只適用于小規模生產。
1.1. 3 噴霧干燥法
將按一定比例配制好的過氧化氫和氫氧化鈣的水懸濁液通過一個有多層圓心通道的噴嘴,進行氣流霧化反應,可直接制得過氧化鈣產品,氣源是脫除水、油及二氧化碳的干燥氮氣,反應壓力為0. 2MPa,反應式如下:
Ca (OH) 2 +H 2 O 2 CaO 2 + 2H 2 O
此法工藝簡單,產品純度高,能耗低,能連續生產。但該法操控難度較大,設備、管道易結垢堵塞,且存在爆炸的危險性
1.2、氧化鈣法
以氧化鈣和雙氧水為原料,通過添加穩定劑,可實現過氧化鈣的常溫合成。通過對反應時間、穩定劑的用量、原料配比等因素對過氧化鈣的合成、純度和產率的影響情況,可實現*佳工藝條件。
采用氧化鈣為原料直接與雙氧水反應制備過氧化鈣。加入穩定劑可以使反應在常溫下進行得到CaO2·8H2O,進行干燥處理。并且反應中沒有銨鹽的加入。新工藝具有反應原料少,產品純度高,沒有外加雜質的引入和三廢排放,是一種清潔的環保生產工藝。
除此之外還有用氧化鈣為鈣源制備過氧化鈣的其它方法。如:通過以氧化鈣和過氧化氫為主要原料,探索在常溫下適當添加堿為穩定劑合成過氧化鈣的新工藝及*佳工藝條件。此方法通過加入適當的堿穩定劑探索了一條常溫水相法合成過氧化鈣的新工藝,所得到的過氧化鈣產品產率和純度較高,穩定性好。與傳統的低溫合成相比,不僅降低了能量消耗和成本,而且該法操作簡便,裝置簡單易控制,為過氧化鈣的工業化生產及應用創造了條件。該方法的改進與傳統的低溫合成方法相比,更有利于合成過氧化鈣的生產及推廣和應用。
1.3、鈣鹽法
1.3. 1 氯化鈣
以氯化鈣和雙氧水為主要原料,可實現過氧化鈣的制備,通過對反應時間、反應溫度、穩定劑的用量、種類、投料配比等因素對過氧化鈣的合成的影響等操控,確定過氧化鈣合成的*佳工藝條件。
該方法制備的過氧化鈣產品含量和產率都達到了60%以上,各項指標都達到了理想要求。
在用氯化鈣與過氧化氫制備過氧化鈣時常常加入氨水,加氨水的目的是中和反應過程中產生的酸,CaCl2在氨水介質中先生成配合物,然后再與過氧化氫反應生成CaO 2·8H 2 O ,經干燥脫水得無水CaO 2。 反應式如下:
CaCl 2·6H 2 O + 2NH 3 →Ca (NH 3 ) 2Cl 2·6H 2 O
Ca(NH 3 ) 2 Cl 2·6H 2 O+2H 2 O 2 →2NH 4 Cl +CaO 2·8H 2 O
CaO 2·8H 2 O →CaO 2 + 8H 2 O
該方法為液—液反應,反應物能充分混合,但需要加入氨水中和副產物HCl,這會使CaO 2產品存在氨的氣味而難以用作食品添加劑,而且銨鹽的存在會使CaO 2分解而造成有效成分含量的降低。如果低溫下反應,可降低H2O2和CaO2 的分解損失,提高H 2 O 2的利用率和產品中CaO 2 的含量。但在低溫下需要制冷設備,其工藝復雜且成本高。目前普遍采用加入穩定劑在常溫下制備的方法,以減少過氧化鈣的分解損失,提高其利用率,并降低成本。
1.3. 2 碳酸鈣
大理石(或石灰石)的主要成分是碳酸鈣,還含有其他金屬離子(錳, 鐵等)及不溶性雜質。通過以大理石,過氧化氫為原料,制備過氧化鈣,將提純后的碳酸鈣溶于適量的鹽酸中,在低溫和堿性條件下,與過氧化氫反應制得過氧化鈣。
鈣鹽法,氫氧化鈣法反應一般控制在0 - 5 ℃進行,均生成 CaO 2·8H 2O。鈣鹽法生產過氧化鈣,產品質量較高,但成本高些;氫氧化鈣法成本較低,但產品質量較低。這兩種方法均可通過在合成時添加適當的活化劑以得到不同程度的克服。
二、過氧化鈣的新生產工藝研究
傳統的氯化鈣法和氫氧化鈣法的優點是工藝過程和設備較簡單,技術較成熟,適合于小規模生產;共同缺點是采用稀溶液生產,大量母液中過氧化氨分解損失大,其產品收率和Ca02含量不可能達到很高,Ca02含量一般僅為50%~60%。噴霧于燥法則采用高濃度過氧化氫和固體(或漿狀)氫氧化鈣直接進行反應,并采用噴霧法脫水干燥,物料中水分少,可減少過氧化氫的分解損失。但該法的問題是控制難度較大,設備、管道易結垢堵塞,且存在爆炸的危險性。另外,國內缺少高濃度的過氧化氫。
而且,過氧化鈣的合成方法雖然有很多種,但是多數是在低溫下反應,需要制冷設備,工藝復雜,成本高。為了簡化工藝,降低成本,提高安全性,唐山金泉冶化科技產業集團旗下“唐山金泉冶化科技產業有限公司技術中心”在傳統Ca(0H)2-NHC1-H02合成法工藝的基礎上,對其常溫下制備過氧化鈣的工藝條件進行了研究和應用。該項工藝采用在反應物料中加入一種穩定劑,減少過氧化氫的分解損失,取得了很好的效果。該法操作簡單,產品收率高,穩定性好。
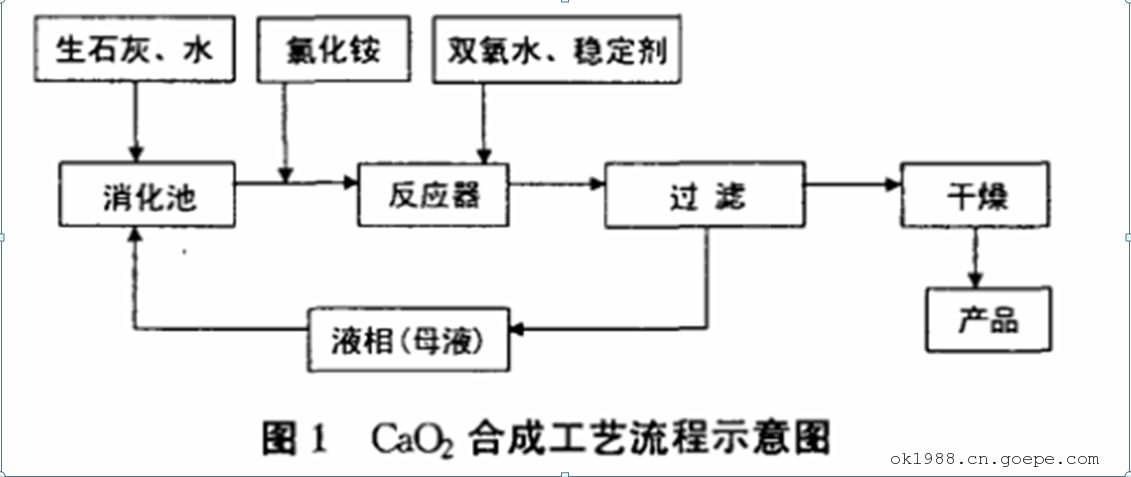
2.1 、CaO2的工藝流程
生石灰與母液和補充水在消化池中消化成石灰乳[Ca(OH)2懸浮液],氯化銨固體加水溶解后,加入石灰乳中。然后將其加入反應器中,與雙氧水反應生成過氧化鈣,為了降低過氧化氫和反應生成的過氧化鈣的分解,其間加入穩定劑。反應一定時間后,將生成的 Ca02料漿過濾分離,其固相再經干燥即為產品,液相(母液)返回消化池,循環使用。
2.2、 CaO2的合成原理
氫氧化鈣在銨鹽溶液中生成絡合物,氨絡合物會解離:
Ca(OH)2+ 2NH4CI→Ca(NH3)2·2H2O→CaCl2+ 2NH3·H2O (1)
游離的 Ca2+與氧化劑H2O2發生化學反應,生成難溶于水的過氧化鈣;
Ca2++2H202→Ca02+2H20 (2)
副反應:
H2O2→H2O+ [O] (3)
2[0] →02↑ (4)
2Ca02+2H20→2Ca(OH)2+02↑ (5)
2.3、CaO2的原料
雙氧水:工業品,含量(含H202)為27%~30%;
生石灰:工業品;
氯化銨:工業品,純度98%;
穩定劑:自配。
2.4、影響過氧化鈣的常溫合成的因素
2.4.1 反應溫度的影響
溫度是決定反應速度的重要因素,升高溫度有利于反應(3)和(4),不利于反應(2)。反應(2)將導致活性氧的損失,反應溫度在 25~29℃時,H2O2利用率僅為70%-80%。從理論上講,低溫反應,可降低 H202和 Ca02的分解損失,可提高產品中 CaO2的含量。反應溫度越低,H2O2利用率*高。過氧化鈣的合成就應該在低溫下進行,需要制冷設備,工藝復雜。成本高。為了簡化工藝,降低成本,采用加入穩定劑在常溫條件下盡可能提高 H2O2的利用率。
在生產過程中,觀察到低溫反應時,放出的氣泡(氧氣)確比常溫下少,所得濕產品Ca02的含量也較高,但在干燥過程中,放出較多的氧氣,活性氧的損失較大,說明 Ca02分解現象較嚴重。加入穩定劑后,常溫下反應所得濕物料產品,在干燥過程中較穩定。因此,常溫下反應所得產品中Ca02的含量比低溫下反應還高。從生產結果看,選擇常溫(20~25℃)的反應條件是可行的。
2.4.2 、反應時間的影響
反應時間也是決定 H202利用率的重要因素,反應時間不宜過短,也不宜過長。過短,反應不完全;過長,則增加產物 CaO2在液相中的停留時間而增加分解損失。當反應溫度 20~25℃,Ca(OH)2過量數 45%~50%,穩定劑用量6%,及其它條件不變時,隨著反應時間的增加H2O2利用率逐漸降低。這是因為反應時間少于15min 時,反應生成 CaO2速度遠大于 CaO2分解速度,CaO2濃度漸上升,當反應時間在15~20min 時反應生成速度等于分解速度,CaO2濃度開始下降,導致 H2O2利用率降低。因此,選擇投料完畢后反應 15~20min是適宜的,此時,H2O2利用率*高>90%,過氧化鈣的含量>70%。
2.4.3 穩定劑的影響
穩定劑的作用是在常溫下降低反應(3)的速度使之與反應(2)的速度相適應。同時可抑制反應(4)的進行。從而提高 H2O2的利用率。當反應溫度 20~25℃,Ca(OH)2過量數45%~50%,反尖時間15~20min,及其它條件不變時。改變穩定劑用量,隨著穩定劑濃度的提高,H2O2利用率逐漸增加,當濃度>6%時(以H2O2的質量分數計),H2O2利用率基本保持不變。因此,選用穩定劑*佳濃度為6%。此時,H202利用率*高>90%,過氧化鈣的含量>70%。
另外,穩定劑的加料方式也應注意,不宜直接加人到石灰乳中,而是加入到雙氧水中較好,以免降低其穩定效果。
2.4.4、 氫氧化鈣過量數的影響
根據反應動力學原理,增加Ca(OH)2的用量,反應(4)的速度降低,從而可提高H2O2的利用率。根據反應(2),以 H202為基準,Ca(OH)2過量0~60%,穩定劑6%,反應時間 15min,及其它條件不變時,隨著 Ca(OH)2過量數的增加,反應(2)速度增加,H202利用率也隨之提高,過量50%時,H202利用率*高。因此,Ca(OH)2過量45%~50%,此時,H202利用率*高>90%,過氧化鈣的含量>70%。
2.4.5、母液循環對生產工藝的影響
過氧化鈣在銨鹽溶液中有一定的溶解性,一次反應,產品收率只有70%左右。采用母液循環,由于CaO2在 NH4+中溶解已達飽和,新生成的 CaO2能完全沉淀,從而提高產率。另外,母液循環還可以少加氯化銨,減少了原材料的消耗,降低生產成本。通過生產及實驗得知:母液循環3次,產品的平均收率可達90%以上。但是,由于生產過程中,水量在不斷增加,若繼續全部循環,會增加設備運轉負荷,降低生產能力。因此,建議母液部分循環,保持生產過程中的物料平衡。
三、總 結
在過氧化鈣的合成方法中, 鈣鹽法和傳統的氫氧化鈣法的工藝過程和設備比較簡單,技術比較成熟,更適合于小規模生產。鈣鹽法和傳統的氫氧化鈣法、空氣陰極法的共同缺點是采用稀溶液生產,大量母液中過氧化氫分解損失嚴重,其產品收率和 CaO2 含量不可能生成過氧化鈣的分解,但通過加入穩定劑,基本上解決了稀溶液法生產過程中產品 CaO2 含量和收率不能兼顧這一矛盾,綜上表明穩定劑的效果良好。
而且,唐山金泉冶化科技產業有限公司提出的上述新工藝以生石灰和雙氧水為原料,通過添加穩定劑,實現了過氧化鈣的常規合成。確定了反應時間、穩定劑用量、氫氧化鈣過量數等因素對過氧化氫利用率和產品純度的影響,確定了*佳工藝條件,實現了過氧化鈣在常溫下的合成。
資料整理編輯:
《石灰產業》編輯部
2024年07月29日
石灰新產業7|二氧化鈣的生產與新工藝應用
一、過氧化鈣的傳統合成工藝
二氧化鈣即過氧化鈣,目前,傳統的過氧化鈣生產方法按所含鈣原料,可分為氫氧化鈣法、氧化鈣法和鈣鹽法(氯化鈣或碳酸鈣)等生產方法。
1.1、氫氧化鈣法
氫氧化鈣法有又可分為傳統法,空氣陰極法和噴霧干燥法。
1.1. 1 傳統法
傳統法主要是利用含鈣的化合物與過氧化物發生氧化還原反應來制備濕的過氧化鈣,然后再經過分離,脫水便可得過氧化鈣產品。
有關過氧化鈣的制備和放氧反應為:
Ca( OH ) 2 + H 2 O 2 → CaO 2 + 2H 2 O ( 1)
CaO 2 + H 2 O→ Ca( OH)2 + O 2 ( 2)
在這兩個反應中,其中反應(1)用于過氧化鈣的制備,反應(2)是過氧化鈣釋放活性氧的機理。
(1)、不用添加劑法
以氫氧化鈣和過氧化物來制備過氧化鈣:過氧化物通常是過氧化氫,Ca (OH) 2 造價較低,所以主要的原料成本來自過氧化氫,而過氧化氫在堿性條件下分解很快,為了降低其分解速度,減少成本,常采用濃的Ca( OH ) 2 懸浮液與H2O 2在常溫下反應制備過氧化鈣。
以氫氧化鈣和雙氧水為原料合成過氧化鈣:首先將反應混合物(漿料)冷卻。再加進氧化鈣去干燥此漿料,同時生成過氧化鈣產品,如需得無水過氧化鈣,則需進一步干燥。若用濃縮的氫氧化鈣水懸液,在冷卻和不斷攪拌下與濃縮的雙氧水反應,反應結束后所得混合物直接噴霧、干燥,不需分離、提純等過程,也可得到分散性好,粒度均勻的無水過氧化鈣產品。
(2)、用添加劑法
用氫氧化鈣制備過氧化鈣:通過加入新型穩定劑磷酸銨合成過氧化鈣,在用氫氧化鈣合成過氧化鈣時,以磷酸二氫鈉為穩定劑。該法不僅設備簡單、操作方便、與傳統的低溫合成法相比,在大大降低了能耗與成本的同時,也帶來了高品質的產品,而且無污染。穩定性好 。
用氫氧化鈣與過氧化氫反應制備過氧化鈣。不加穩定劑時,一般需要在0~5 ℃下進行反應;加入穩定劑后,反應可在室溫下進行。由于氫氧化鈣微溶于水,也有使其先在銨鹽溶液中溶解生成氨絡合物,然后利用絡合物解離出的Ca 2 +與H2O2反應,生成過氧化鈣的制備方法。
1.1. 2 空氣陰極法
空氣陰極法制備過氧化鈣的工藝,實質上是把過氧化鈣的合成與過氧化氫的生產結合起來,通過降低關鍵原料過氧化氫的成本,來降低*終產品過氧化鈣的生產成本。其基本原理是,在堿性條件下,空氣中的氧和水在特制的陰極上直接還原得過氧化氫,然后加入氫氧化鈣進行反應制得產品過氧化鈣
陰極:O 2 + H 2 O + 2e - → HO - 2 +OH -
陽極: 2OH - → 2e - +H 2 O + 1 /2O 2
此法生產能力比較小,只適用于小規模生產。
1.1. 3 噴霧干燥法
將按一定比例配制好的過氧化氫和氫氧化鈣的水懸濁液通過一個有多層圓心通道的噴嘴,進行氣流霧化反應,可直接制得過氧化鈣產品,氣源是脫除水、油及二氧化碳的干燥氮氣,反應壓力為0. 2MPa,反應式如下:
Ca (OH) 2 +H 2 O 2 CaO 2 + 2H 2 O
此法工藝簡單,產品純度高,能耗低,能連續生產。但該法操控難度較大,設備、管道易結垢堵塞,且存在爆炸的危險性
1.2、氧化鈣法
以氧化鈣和雙氧水為原料,通過添加穩定劑,可實現過氧化鈣的常溫合成。通過對反應時間、穩定劑的用量、原料配比等因素對過氧化鈣的合成、純度和產率的影響情況,可實現*佳工藝條件。
采用氧化鈣為原料直接與雙氧水反應制備過氧化鈣。加入穩定劑可以使反應在常溫下進行得到CaO2·8H2O,進行干燥處理。并且反應中沒有銨鹽的加入。新工藝具有反應原料少,產品純度高,沒有外加雜質的引入和三廢排放,是一種清潔的環保生產工藝。
除此之外還有用氧化鈣為鈣源制備過氧化鈣的其它方法。如:通過以氧化鈣和過氧化氫為主要原料,探索在常溫下適當添加堿為穩定劑合成過氧化鈣的新工藝及*佳工藝條件。此方法通過加入適當的堿穩定劑探索了一條常溫水相法合成過氧化鈣的新工藝,所得到的過氧化鈣產品產率和純度較高,穩定性好。與傳統的低溫合成相比,不僅降低了能量消耗和成本,而且該法操作簡便,裝置簡單易控制,為過氧化鈣的工業化生產及應用創造了條件。該方法的改進與傳統的低溫合成方法相比,更有利于合成過氧化鈣的生產及推廣和應用。
1.3、鈣鹽法
1.3. 1 氯化鈣
以氯化鈣和雙氧水為主要原料,可實現過氧化鈣的制備,通過對反應時間、反應溫度、穩定劑的用量、種類、投料配比等因素對過氧化鈣的合成的影響等操控,確定過氧化鈣合成的*佳工藝條件。
該方法制備的過氧化鈣產品含量和產率都達到了60%以上,各項指標都達到了理想要求。
在用氯化鈣與過氧化氫制備過氧化鈣時常常加入氨水,加氨水的目的是中和反應過程中產生的酸,CaCl2在氨水介質中先生成配合物,然后再與過氧化氫反應生成CaO 2·8H 2 O ,經干燥脫水得無水CaO 2。 反應式如下:
CaCl 2·6H 2 O + 2NH 3 →Ca (NH 3 ) 2Cl 2·6H 2 O
Ca(NH 3 ) 2 Cl 2·6H 2 O+2H 2 O 2 →2NH 4 Cl +CaO 2·8H 2 O
CaO 2·8H 2 O →CaO 2 + 8H 2 O
該方法為液—液反應,反應物能充分混合,但需要加入氨水中和副產物HCl,這會使CaO 2產品存在氨的氣味而難以用作食品添加劑,而且銨鹽的存在會使CaO 2分解而造成有效成分含量的降低。如果低溫下反應,可降低H2O2和CaO2 的分解損失,提高H 2 O 2的利用率和產品中CaO 2 的含量。但在低溫下需要制冷設備,其工藝復雜且成本高。目前普遍采用加入穩定劑在常溫下制備的方法,以減少過氧化鈣的分解損失,提高其利用率,并降低成本。
1.3. 2 碳酸鈣
大理石(或石灰石)的主要成分是碳酸鈣,還含有其他金屬離子(錳, 鐵等)及不溶性雜質。通過以大理石,過氧化氫為原料,制備過氧化鈣,將提純后的碳酸鈣溶于適量的鹽酸中,在低溫和堿性條件下,與過氧化氫反應制得過氧化鈣。
鈣鹽法,氫氧化鈣法反應一般控制在0 - 5 ℃進行,均生成 CaO 2·8H 2O。鈣鹽法生產過氧化鈣,產品質量較高,但成本高些;氫氧化鈣法成本較低,但產品質量較低。這兩種方法均可通過在合成時添加適當的活化劑以得到不同程度的克服。
二、過氧化鈣的新生產工藝研究
傳統的氯化鈣法和氫氧化鈣法的優點是工藝過程和設備較簡單,技術較成熟,適合于小規模生產;共同缺點是采用稀溶液生產,大量母液中過氧化氨分解損失大,其產品收率和Ca02含量不可能達到很高,Ca02含量一般僅為50%~60%。噴霧于燥法則采用高濃度過氧化氫和固體(或漿狀)氫氧化鈣直接進行反應,并采用噴霧法脫水干燥,物料中水分少,可減少過氧化氫的分解損失。但該法的問題是控制難度較大,設備、管道易結垢堵塞,且存在爆炸的危險性。另外,國內缺少高濃度的過氧化氫。
而且,過氧化鈣的合成方法雖然有很多種,但是多數是在低溫下反應,需要制冷設備,工藝復雜,成本高。為了簡化工藝,降低成本,提高安全性,唐山金泉冶化科技產業集團旗下“唐山金泉冶化科技產業有限公司技術中心”在傳統Ca(0H)2-NHC1-H02合成法工藝的基礎上,對其常溫下制備過氧化鈣的工藝條件進行了研究和應用。該項工藝采用在反應物料中加入一種穩定劑,減少過氧化氫的分解損失,取得了很好的效果。該法操作簡單,產品收率高,穩定性好。
2.1 、CaO2的工藝流程
生石灰與母液和補充水在消化池中消化成石灰乳[Ca(OH)2懸浮液],氯化銨固體加水溶解后,加入石灰乳中。然后將其加入反應器中,與雙氧水反應生成過氧化鈣,為了降低過氧化氫和反應生成的過氧化鈣的分解,其間加入穩定劑。反應一定時間后,將生成的 Ca02料漿過濾分離,其固相再經干燥即為產品,液相(母液)返回消化池,循環使用。
2.2、 CaO2的合成原理
氫氧化鈣在銨鹽溶液中生成絡合物,氨絡合物會解離:
Ca(OH)2+ 2NH4CI→Ca(NH3)2·2H2O→CaCl2+ 2NH3·H2O (1)
游離的 Ca2+與氧化劑H2O2發生化學反應,生成難溶于水的過氧化鈣;
Ca2++2H202→Ca02+2H20 (2)
副反應:
H2O2→H2O+ [O] (3)
2[0] →02↑ (4)
2Ca02+2H20→2Ca(OH)2+02↑ (5)
2.3、CaO2的原料
雙氧水:工業品,含量(含H202)為27%~30%;
生石灰:工業品;
氯化銨:工業品,純度98%;
穩定劑:自配。
2.4、影響過氧化鈣的常溫合成的因素
2.4.1 反應溫度的影響
溫度是決定反應速度的重要因素,升高溫度有利于反應(3)和(4),不利于反應(2)。反應(2)將導致活性氧的損失,反應溫度在 25~29℃時,H2O2利用率僅為70%-80%。從理論上講,低溫反應,可降低 H202和 Ca02的分解損失,可提高產品中 CaO2的含量。反應溫度越低,H2O2利用率*高。過氧化鈣的合成就應該在低溫下進行,需要制冷設備,工藝復雜。成本高。為了簡化工藝,降低成本,采用加入穩定劑在常溫條件下盡可能提高 H2O2的利用率。
在生產過程中,觀察到低溫反應時,放出的氣泡(氧氣)確比常溫下少,所得濕產品Ca02的含量也較高,但在干燥過程中,放出較多的氧氣,活性氧的損失較大,說明 Ca02分解現象較嚴重。加入穩定劑后,常溫下反應所得濕物料產品,在干燥過程中較穩定。因此,常溫下反應所得產品中Ca02的含量比低溫下反應還高。從生產結果看,選擇常溫(20~25℃)的反應條件是可行的。
2.4.2 、反應時間的影響
反應時間也是決定 H202利用率的重要因素,反應時間不宜過短,也不宜過長。過短,反應不完全;過長,則增加產物 CaO2在液相中的停留時間而增加分解損失。當反應溫度 20~25℃,Ca(OH)2過量數 45%~50%,穩定劑用量6%,及其它條件不變時,隨著反應時間的增加H2O2利用率逐漸降低。這是因為反應時間少于15min 時,反應生成 CaO2速度遠大于 CaO2分解速度,CaO2濃度漸上升,當反應時間在15~20min 時反應生成速度等于分解速度,CaO2濃度開始下降,導致 H2O2利用率降低。因此,選擇投料完畢后反應 15~20min是適宜的,此時,H2O2利用率*高>90%,過氧化鈣的含量>70%。
2.4.3 穩定劑的影響
穩定劑的作用是在常溫下降低反應(3)的速度使之與反應(2)的速度相適應。同時可抑制反應(4)的進行。從而提高 H2O2的利用率。當反應溫度 20~25℃,Ca(OH)2過量數45%~50%,反尖時間15~20min,及其它條件不變時。改變穩定劑用量,隨著穩定劑濃度的提高,H2O2利用率逐漸增加,當濃度>6%時(以H2O2的質量分數計),H2O2利用率基本保持不變。因此,選用穩定劑*佳濃度為6%。此時,H202利用率*高>90%,過氧化鈣的含量>70%。
另外,穩定劑的加料方式也應注意,不宜直接加人到石灰乳中,而是加入到雙氧水中較好,以免降低其穩定效果。
2.4.4、 氫氧化鈣過量數的影響
根據反應動力學原理,增加Ca(OH)2的用量,反應(4)的速度降低,從而可提高H2O2的利用率。根據反應(2),以 H202為基準,Ca(OH)2過量0~60%,穩定劑6%,反應時間 15min,及其它條件不變時,隨著 Ca(OH)2過量數的增加,反應(2)速度增加,H202利用率也隨之提高,過量50%時,H202利用率*高。因此,Ca(OH)2過量45%~50%,此時,H202利用率*高>90%,過氧化鈣的含量>70%。
2.4.5、母液循環對生產工藝的影響
過氧化鈣在銨鹽溶液中有一定的溶解性,一次反應,產品收率只有70%左右。采用母液循環,由于CaO2在 NH4+中溶解已達飽和,新生成的 CaO2能完全沉淀,從而提高產率。另外,母液循環還可以少加氯化銨,減少了原材料的消耗,降低生產成本。通過生產及實驗得知:母液循環3次,產品的平均收率可達90%以上。但是,由于生產過程中,水量在不斷增加,若繼續全部循環,會增加設備運轉負荷,降低生產能力。因此,建議母液部分循環,保持生產過程中的物料平衡。
三、總 結
在過氧化鈣的合成方法中, 鈣鹽法和傳統的氫氧化鈣法的工藝過程和設備比較簡單,技術比較成熟,更適合于小規模生產。鈣鹽法和傳統的氫氧化鈣法、空氣陰極法的共同缺點是采用稀溶液生產,大量母液中過氧化氫分解損失嚴重,其產品收率和 CaO2 含量不可能生成過氧化鈣的分解,但通過加入穩定劑,基本上解決了稀溶液法生產過程中產品 CaO2 含量和收率不能兼顧這一矛盾,綜上表明穩定劑的效果良好。
而且,唐山金泉冶化科技產業有限公司提出的上述新工藝以生石灰和雙氧水為原料,通過添加穩定劑,實現了過氧化鈣的常規合成。確定了反應時間、穩定劑用量、氫氧化鈣過量數等因素對過氧化氫利用率和產品純度的影響,確定了*佳工藝條件,實現了過氧化鈣在常溫下的合成。
資料整理編輯:
《石灰產業》編輯部
2024年07月29日